
取消
清空记录
历史记录
清空记录
历史记录


“不死的癌症”系统性红斑狼疮或可被攻克?
近期,备受瞩目的“红斑狼疮”成为热搜话题。系统性红斑狼疮 (SLE) 是一种系统性自身免疫疾病,可导致肾脏、心血管、肺、消化系统、血液系统、血管和眼部等多器官损伤,严重可导致死亡。由于这种疾病无法根治,只能通过正规科学的治疗控制病情,所以也被称为“不死的癌症”。
肠道是人体最大的免疫器官,在维持机体正常的免疫防御功能中发挥着重要的作用。人体肠道为微生物提供了良好的栖息环境,成人肠道内的微生物数量为1014个,接近人体体细胞数量的10倍。随着高通量技术的发展,研究发现肠道菌群及其代谢产物通过多种途径调节免疫系统,对宿主的免疫稳态起重要作用。通常情况下肠道菌群介导的免疫平衡状态,既能抵抗外来细菌又能保持自身耐受;当肠道菌群发生改变时,可能会导致免疫反应的失调,进而引起自身免疫性疾病。近年来,研究学者对SLE患者肠道菌群组成的变化进行了深入研究,认为肠道菌群失衡是SLE重要的环境自身免疫原和炎症诱因。
SLE患者的肠道菌群变化
SLE患者的肠道菌群变化
既往研究发现红斑狼疮患者和健康人的肠道菌群差异:
-
Hevia[1]等研究认为厚壁菌门/拟杆菌门的比例降低是SLE患者肠道菌群改变的代表性特征。
-
Li[2]等报道SLE患者肠道在菌属层面链球菌属和乳杆菌属显著增多,而费氏杆菌属显著减少,且链球菌属及其菌种咽峡炎链球菌与SLE疾病活动指数(SLEDAI) 正相关,说明其对SLE具有潜在致病作用。
-
另有研究[3]结果显示SLE患者肠道的活泼瘤胃球菌丰度明显升高,与狼疮性肾炎患者呈正相关。活泼瘤胃球菌可能作用于免疫反应的不同阶段,参与多种自身免疫病进展。
-
Chen[4]等比较健康人群以及SLE患者治疗前后的肠道菌群变化情况,发现SLE患者肠道中的梭菌、脆弱拟杆菌以及柔嫩梭菌等富集现象明显,治疗后的丰度下降。
李兰娟院士团队[5]于2022年8月发表一篇关于SLE和肠道菌群关系的综述,并讨论了调节肠道菌群在控制SLE中的应用前景。
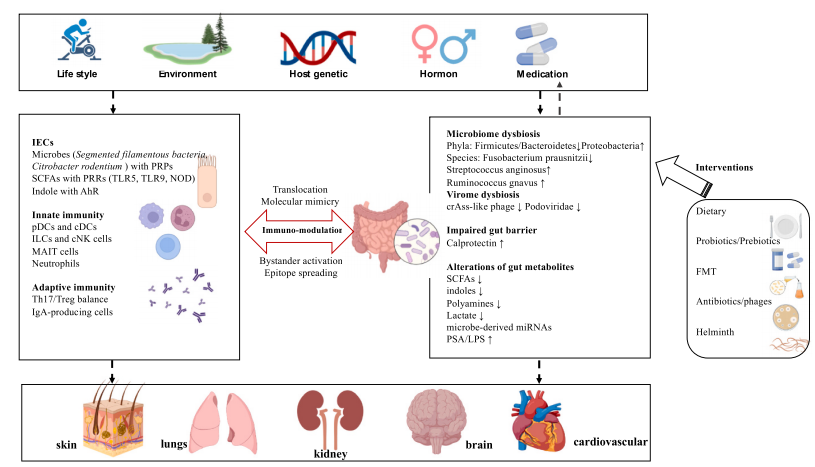
文章主要观点:
-
SLE患者肠道菌群多样性和丰度降低,并伴随细菌、病毒和真菌种群的特征性变化,且存在肠屏障功能损伤;
-
肠道菌群及其代谢产物 (短链脂肪酸、色氨酸、多胺、乳酸、MicroRNAs和脂多糖等) 通过易位、分子拟态、旁位活化、抗原表位扩展等机制调节宿主免疫稳态;
-
多种SLE药物通过调节患者肠道菌群发挥作用;
-
通过粪菌移植、益生菌/益生元、抗生素、噬菌体疗法、饮食干预及蠕虫疗法等调节肠道菌群可控制SLE进展。
菌群移植&SLE
来自中南大学附属第二医院的团队[6]招募了20例标准治疗下疾病活动指数2000仍评分≥6分的活动性SLE患者,在原有稳定的治疗基础上每周口服菌群胶囊治疗一次,连续治疗三周,随后对患者进行了12周的随访。

研究发现:
-
第12周时,SLE复合应答指数4应答率为42.12%;FMT治疗后SLEDAI-2K评分和血清抗dsDNA抗体水平较基线均显著降低。
-
FMT干预后,患者肠道菌群的α多样性增加,产生短链脂肪酸 (SCFAs) 的相关菌属明显富集,与炎症相关的细菌分类群减少,肠道中SCFAs的产生增加,外周血中IL-6水平和CD4和记忆T细胞/初始T细胞比值降低。
结论:该临床试验首次证实了FMT有效地改变了SLE患者的肠道微生物群落并改变了短链脂肪酸代谢谱。该研究成果表明FMT可能是SLE患者可行的、安全和有效的治疗方法。
参考文献
[1] Hevia A, Milani C, López P, et al. mBio. 2014 Sep 30;5(5):e01548-14.
[2] Li Y, Wang HF, Li X, et al. Clin Sci (Lond). 2019 Apr 15;133(7):821-838.
[3] Azzouz D, Omarbekova A, Heguy A, et al. Ann Rheum Dis. 2019 Jul;78(7):947-956.
[4] Chen BD, Jia XM, Xu JY, et al. Arthritis Rheumatol. 2021 Feb;73(2):232-243.
[5] Chen Y, Lin J, Xiao L, et al. J Autoimmun. 2022 Aug 2;132:102867.
[6] Huang C, Yi P, Zhu M, et al. J Autoimmun. 2022 Jun;130:102844.



 浏览器自带分享功能也很好用哦~
浏览器自带分享功能也很好用哦~